常见的纳米酶大多数是金属化合物纳米颗粒,其催化活性主要是来自在纳米颗粒表面的金属离子。在自然界中,生物酶的特征表明活性位点和支持、稳定活性位点的网络环境对于高催化效率同样重要。通过调整活性位点的成分和环境可以实现高的活性和选择性。水凝胶是一类具有良好生物相容性的三维亲水网络材料,其结构可以有效地保护酶分子活性中心,同时提供更好的底物迁移微环境,从而实现有效的催化作用,载酶水凝胶材料已成为生物学研究中的热点。纳米凝胶为水凝胶的纳米粒子,具有类似于宏观水凝胶材料的亲水网络及类似流体的传输特性,其纳米的尺寸可以作为进一步体内生物应用的理想载体。在受限的纳米空间中实现修饰或组装以获得杂化纳米凝胶仍然存在挑战。
应对这一挑战,同济大学化学科学与工程学院王启刚团队从仿生的角度出发,设计了一种酶催化的原子转移自由基聚合(ATRPase)和金属配位交联方法成功制备出纳米人工多酶凝胶体系。该体系具有模拟超氧化物歧化酶(SOD-like)和过氧化物酶(POD-like)特性,可以实现肿瘤微环境级联催化的响应成像。日前,相关研究成果以“Multienzyme‐Mimic Nanogels Synthesized by Biocatalytic ATRP and Metal Coordination for Bioresponsive Fluorescence Imaging”为题,发表在国际著名学术期刊Angewandte Chemie International Edition(《德国应用化学》)上。同济大学化学科学与工程学院为该文的唯一通讯作者单位,硕士生齐美园为第一作者,王霞副教授和王启刚教授为共同通讯作者。
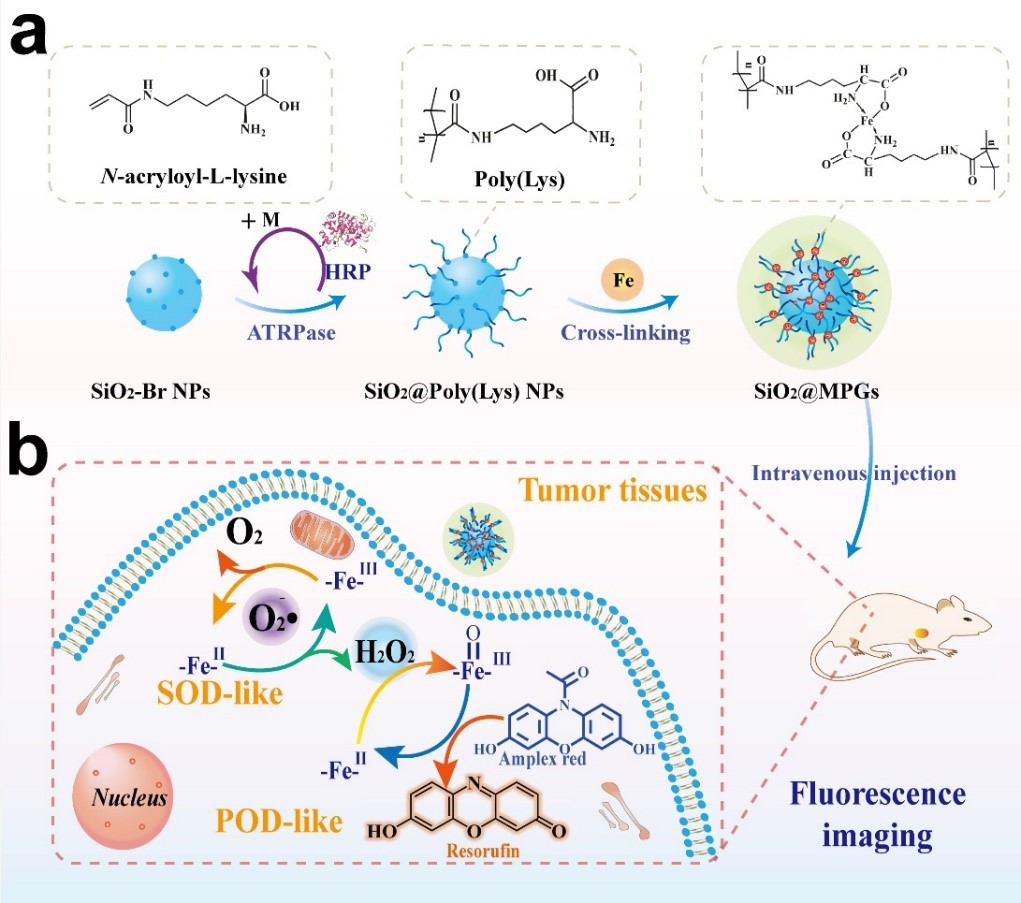
图1.(a)人工多酶凝胶体系的ATRPase及配位交联制备流程(b)模拟SOD和POD级联酶催化的肿瘤微环境响应的荧光成像机制。
研究人员首先在纳米粒子表面修饰酶催化的原子转移自由基聚合的引发剂(-Br),以具有良好生物相容性的生物酶为催化剂,修饰有双键的赖氨酸(N-acryloyl-L-lysine)为聚合单体,在纳米粒子周围聚合制备得到聚赖氨酸高分子刷,最后通过亚铁配位交联,从而构建出具有多酶活性的人工多酶凝胶体系(如图1所示)。凝胶体系中高分散的Fe离子一方面作为凝胶网络的交联剂,同时作为模拟酶的活性中心。通过模拟SOD和POD酶,先将肿瘤部位高水平的O2•−催化转化为H2O2,进一步基于肿瘤部位提升的H2O2通过级联酶催化反应实现肿瘤微环境响应的安全、高效的肿瘤成像。该人工多酶凝胶体系类似自然的过氧化物酶催化机制不产生羟基自由基,具有低毒性和高生物安全性。同时,ATRPase方法和金属配位交联技术可进一步实现多种纳米材料体系的制备,用于药物输送和其他生物医学应用。
该研究成果得到了国家自然科学基金、国家重点研发计划等经费支持以及中国科学院强磁场科学中心的技术支持。王启刚教授团队多年来一直致力于高分子凝胶固定酶技术及其生物诊疗应用,近5年累计以通讯作者在Adv.Mater., Nat. Commun., Angew. Chem. Inter. Ed.等期刊发表SCI论文50多篇。
文献链接:https://www.onlinelibrary.wiley.com/doi/abs/10.1002/anie.202002331




